
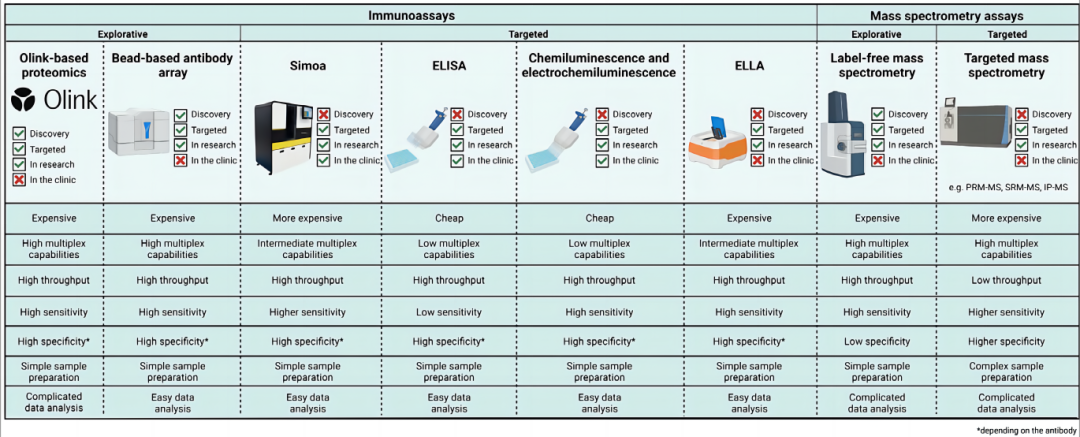
体液样本中生物标志物的发现与验证,是实现疾病精准诊断与治疗,了解疾病发生机制,发现药物靶点及探究其潜在作用机制等的重要手段,本文以神经退行性疾病为例,整理了当前可用于体液蛋白质组检测技术,主要包括基于质谱和免疫分析两大类。
01 基于质谱的分析方法
Label-free质谱检测
Label-free质谱检测(LF-MS)采用“自下而上”的分析策略对多种体液或组织样本进行非靶向蛋白含量分析。该方法以肽为中心,首先进行蛋白酶解消化产生肽段,然后在肽水平上进行蛋白质推导,获得累积信号对蛋白进行定量。不需要化学标签或内标,通常用于大规模蛋白质组学研究。可在多种质谱平台上开展,如电喷雾电离和高精度质量分析仪,包括轨道阱、四级杆和飞行时间。质谱分析数据采集模式包括DDA和DIA。
靶向定量质谱检测
主要包括多反应监测(MRM)和平行反应监测(PRM)
MRM:低分辨率的三重四级杆(QQQ)质谱仪
PRM:高分辨率质量分析仪,如四级杆-Orbitrap或Q-TOF系统
通过在样本中添加同位素标记的蛋白质/肽,同时监测内源肽和同位素标记肽,实现目标蛋白的定量检测。因此开展靶向MS前需提前确定目标蛋白质及其特异性肽段,以创建特定的靶向方法。
技术特点
MS检测不依赖于抗体,鉴定蛋白范围广泛、高特异性。但技术复杂,需专业人员及实验室提供专用设备和仪器。
LF-MS及其生物分析流程可无偏倚的鉴定特定疾病状态下的蛋白谱,可用于生物标志物的发现。
优势:实验设置简单,无需标记和后续复杂的实验设计,适用于多种样本类型(细胞培养物、生物液体、组织提取物等)。
劣势:重现性差,尤其在使用DDA方法时,变异系数在15%-20%之间,缺失值比例大。通量小,差异表达分析不如基于标记的方法准确。
MRM-MS/PRM-MS可以用于队列验证,并以更高的灵敏度及可重复方式检测、定量低丰度蛋白。
PRM可以回顾性的选择用于定量的相关离子对,无需在分析前进行选择,特异性高。
发展前景
研究显示在发现一些针对阿尔兹海默症(AD)的关键血液生物标志物(如淀粉样蛋白和 tau 蛋白)方面,定量靶向 MS 方法优于免疫检测。因此,质谱应用于临床具有一定的前景,但在技术和成本方面需进行重大改进,使之与常规应用兼容。利用 MS 的高效并行性能来量化一组生物标志物,结合不同生物标志物建立有效且可靠的算法,例如神经退行性变、神经炎症、突触功能和共病理等,也非常值得期待。
02 基于抗体的检测方法
基于邻位延伸分析的蛋白质组学
邻位延伸阵列 (PEA) 技术是一种基于多重抗体的蛋白质组学方法,目前可检测超过 3000 种蛋白质。它结合了基于抗体和 DNA 的方法来测量不同体液(例如血液和脑脊液)样本中的蛋白质水平。
技术特点
优势:同时检测数千种蛋白,检测灵敏度高,仅需微量样本。
劣势:蛋白选择具有偏倚,可能高估与抗体结合能力较好的蛋白而低估没有抗体或与抗体结合能力较弱的蛋白。大多数检测 panel 只能提供蛋白浓度的相对定量,导致无法直接比较同一批次的不同蛋白,或不同批次的相同蛋白。
发展前景
随着新型蛋白的鉴定及高特异性抗体的开发,PEA 的检测范围可进一步扩展。可开展针对特定疾病的定制产品,包括用于绝对定量的标准品。随着 PEA 在越来越多研究中的应用,跨疾病的 meta 分析将变得重要,为了更深入的探索蛋白质组,已开展结合 PEA、Somascan 和 MS 的多平台蛋白质组学研究。
基于微球的多重蛋白质组学分析
基于微球的微阵列技术利用抗体结合的多重分析方法,实现高通量多重蛋白质分析。将高度特异的捕获抗体固定在荧光编码的磁性微球表面,混合后形成悬浮微球阵列,在微孔板中同时进行多种蛋白的定性定量分析。已建立的用于脑脊液和血浆的分析方法中,能够平行分析 384 个样本中的 384 靶标蛋白。
技术特点
优势:高通量,多个目标蛋白并行分析,样本消耗少,制备和工作流程简单,相对较高的灵敏度和特异性。检测限范围通常在 pg/mL 到 ng/mL。标准曲线可在单个分析中形成,进而开展绝对定量评估,并随着时间的累积形成标准曲线数据集。不同磁珠在一定程度上可自由组合,针对特定研究领域定制蛋白检测 panel。还可以使用相同的试剂从多重探索性研究转换为针对性的验证性研究。
劣势:不适合大范围研究(不能包含所有蛋白的标准曲线),成本高,需要进行生物学和技术重现性验证。
发展前景
随着抗体增加,进一步扩大检测和应用范围。通过开发新的检测技术(如光激发化学发光免疫法),可以提高检测灵敏度和并行检测性能。
酶联免疫吸附测定
酶联免疫吸附测定(ELISA )是一种基于抗体检测液体基质中的痕量蛋白质的技术。
技术特点
优势:对脑脊液样本中神经痕量蛋白检测具有较高的灵敏度。
劣势:对血液样本灵敏度较差,优化适合 ELISA 的抗体往往需要较长时间。
发展前景
ELISA 在临床诊断中占主导地位,但体外诊断行业的未来在于免疫分析数字化及多重化。
化学发光和电化学发光
化学发光(CLIA)和电化学发光免疫分析(ELC)都是基于封闭抗体系统的检测,通过磁珠偶联的生物素-链霉亲和素捕获免疫复合物,分析反应的指示剂是发光。
技术特点
优势:相较比色法(如ELISA),对分析反应进行绝对定量,动态范围大,具有高灵敏度和特异性。
劣势:成本高,分析物检测和测试panel的可用性有限,分析系统封闭。
发展前景
CLIA 显示出用于多重免疫测定的巨大潜力,这种测定在临床应用中越来越受欢迎。随着这些技术的发展,新型生物标志物转化为临床应用的速度将会加快。
Simoa
Simoa 是一种基于磁珠的 ELISA,可在 Quanterix HD-X/HD-1 全自动分析仪或 SR-X 分析仪上运行。
技术特点
优势:灵敏度高,较 ELISA 高 1000 倍以上,检测下限达到 fg/mL 级别,实现超低丰度蛋白的有效检测和定量。通量高,多重检测能力,可根据试验目的进行方案开发和优化。
劣势:仪器及试剂耗材成本高,需要专业人员保证平台的正确操作和维护。
发展前景
研究显示,通过提高磁珠读取效率可进一步优化 Simoa,改进后允许检测低至亚原子浓度的蛋白质,这种灵敏度可能会为新基质中生物标志物的检测打开一扇机会之窗。
微流控免疫分析
ProteinSimple 全自动微流控免疫分析仪提供了微流控免疫分析(ELLA)平台,将特异性捕获抗体包被在微流体玻璃反应管(GNR)中,再将三个 GNR 嵌入全自动微流体免疫检测管。目标分析物与捕获抗体结合,在检测抗体作用下,每个样本会自动输出 3 个平行 GNR 的数据和均值。浓度通过使用已校准的标准曲线生成,该系统可用于单一和多重检测。
技术特点
优势:ELLA 是一款小型台式机器,操作简便,通量高,提供开放式墨盒版本,允许客户按照需求设置检测。
劣势:成本高,对于 Nfl 或细胞因子的灵敏度不及 Simoa。
发展前景
小型且易于使用的台式 ELLA 平台可用于临床低丰度生物标志物的常规检测,还可用于急诊或重症监护病房中的即时监测。
蛋白质组学和转录组学联合应用
尽管蛋白质组检测结果更加直接,但转录组分析在神经退行性疾病领域也有一些重要应用。健康个体与患者之间蛋白质丰度差异可能有多种原因:1.蛋白丰度直接影响疾病,例如蛋白不降解、磷酸化或聚集在一起;2.疾病可能引起基因调控改变进而影响蛋白水平。后者可以通过RNA-seq进行分析,因此蛋白和转录组联合分析可以提供更多的信息从而揭示疾病发生的分子机制。
【参考文献】Teunissen CE, Kimble L, Bayoumy S, et al. Methods to Discover and Validate Biofluid-Based Biomarkers in Neurodegenerative Dementias. Mol Cell Proteomics. 2023 Oct;22(10):100629.