
近日,天津医科大学总医院神经外科教授、天津市神经病学研究所副所长康春生教授团队联合天津市临床多组学重点实验室在 CNS Neuroscience & Therapeutics上发表题为“Deep-targeted gene sequencing reveals ARID1A mutation as an important driver of glioblastoma”的文章,基于深度靶向基因测序技术证实 ARID1A 基因是神经胶质瘤的关键预测生物标志物,揭示 ARID1A 突变促进胶质瘤进展,介导替莫唑胺耐药的潜在分子机制。
胶质瘤是最常见的原发性中枢神经系统恶性肿瘤,目前胶质母细胞瘤(GBM)的治疗效果不甚理想,可能与替莫唑胺(TMZ)治疗后快速耐药及导致的遗传异质性相关。研究表明 TMZ 可通过介导全基因组 DNA 烷基化来激活 DNA 错配修复机制。而 DNA 错配修复异常导致的基因组不稳定是肿瘤发生、复发及化疗耐药的关键驱动因素,对 DNA 损伤修复(DDR)基因突变导致的表达谱改变与 GBM 化疗耐药的内在联系进行深入研究,可提高对胶质瘤治疗耐药的认识。
|研究方法| 对 228 个原发性胶质瘤样本进行深度靶向基因测序,全面分析 428 个与 DDR 和基因组不稳定通路相关基因的突变情况,识别不同级别神经胶质瘤的差异突变基因,使用 I-TASSER 进行同源建模,阐明这些基因突变导致的蛋白功能改变及其对胶质瘤进展的影响。 |研究结果| 研究显示,DDR 相关基因 ARID1A 在 GBM 中频繁发生,显著高于低级别胶质瘤。ARID1A 是 GBM 患者重要的预后标志物,其突变与胶质瘤患者预后呈负相关(p=0.0217),且与 NF1 具有协同作用,发生 NF1 与 ARID1A 共突变者比非突变患者预后更差(p=0.0137)。ARID1A 突变后 GBM 细胞 Ki-67、pERK、pMEK1/2 表达水平显著增加,提示 ARID1A 突变是 GBM 重要的分子事件,可能与 Ras/Raf/MEK/ERK 通路的异常激活相关。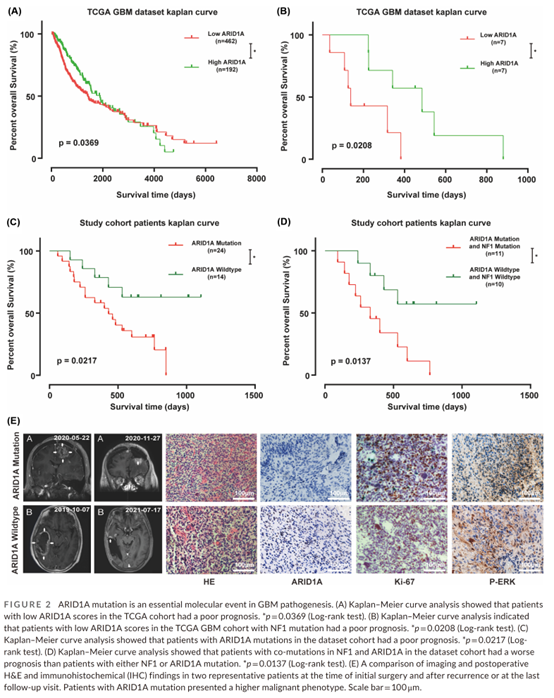
利用 siRNA 干扰构建的 ARID1A KD 细胞系中,CDK4、CDK6、CCND1 和 CDK2 的表达水平高于野生型,同时细胞凋亡关键蛋白 BAX 及其下游效应蛋白 caspase-3/7 的表达水平显著下降,表明 ARID1A 表达缺失可能导致细胞凋亡减少及细胞周期加速,从而促进胶质瘤细胞的恶性表型。
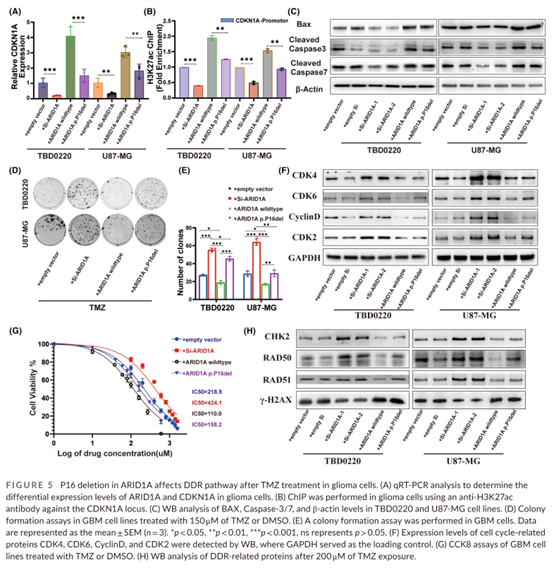
蛋白结构模拟分析显示,高频突变 P16 缺失可改变 ARID1A 蛋白结构并破坏结构稳定性。相比野生型,ARID1A-P16 缺失有效阻断了与 SWI/SNF 复合物核心受体 BRG1 蛋白的结合,减弱 SWI/SNF 复合物的整体稳定性,并改变其细胞内组蛋白修饰活性。进一步构建了 ARID1A 对照、ARID1A KD、ARID1A 野生型过表达和 ARID1A-P16 缺失过表达等 4 种模型,分析 4 种改变对 DDR 通路关键功能蛋白 CDKN1A 的修饰及表达情况的影响。结果显示 ARID1A 与 CDKN1A 表达呈正相关,与野生型过表达相比,ARID1A-P16 缺失导致 CDKN1A 表达减少。此外, ARID1A KD 和 ARID1A-P16 缺失型中 CDKN1A 启动子区 H3K27 区域乙酰化显著减少,有力证明了 ARID1A 可能通过组蛋白乙酰化修饰影响 CDKN1A 转录,进而影响胶质瘤细胞的生物活性。 研究同时探究体内和体外条件下 ARID1A 突变对于 TMZ 疗效的影响。与 ARID1A 野生型相比,ARID1A KD 细胞系响应 TMZ 治疗后,GBM 凋亡显著减少,并有明显的克隆生长。同时,ARID1A KD 小鼠模型也表现出肿瘤体积和 Ki-67 表达量均高于对照,其生长曲线表现出更恶性的生物学特征。TMZ 灌胃治疗无法有效抑制肿瘤增殖。Kaplan-Meier 生存曲线显示中位生存期显著缩短(25d vs 31d)。为进一步阐明潜在机制,比较了 ARID1A 野生型、ARID1A KD 和 ARID1A-P16 缺失与 GBM 对照细胞系中细胞周期蛋白及 DNA 损伤修复蛋白的变化,使用 200 μm TMZ 处理后,ARID1A-P16 缺失细胞系 CDK4、CDK6、CCND1 和 CDK2 的表达水平高于野生型,且 DDR 蛋白(包括RAD50)也同样受到影响。这些发现证实 ARID1A 突变在调节 GBM 对 TMZ 反应的关键作用。 |研究结论|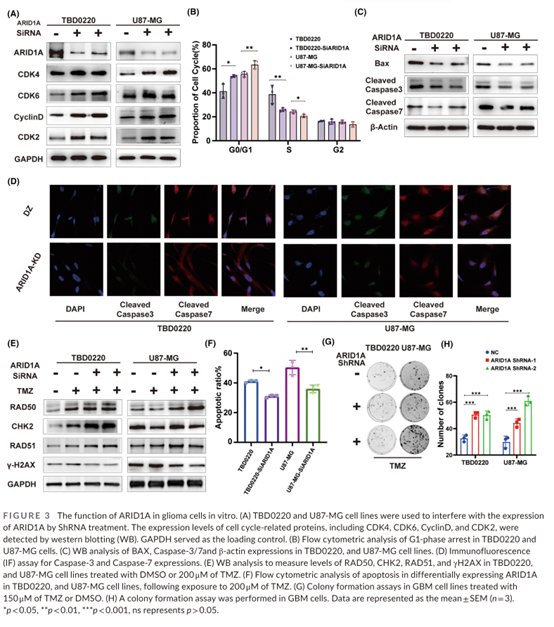
本研究揭示 ARID1A 基因是神经胶质瘤的关键预测生物标志物,该基因突变后可改变 SWI/SNF 复合物的稳定性,影响胶质瘤转录调控。进一步导致 GBM 恶性表型增加,同时也在介导化疗耐药中发挥关键作用。